INSEMINACIÓN ARTIFICIAL EN CERDAS
INTRODUCCIÓN
A lo largo de la
historia la inseminación artificial (IA) ha tenido grandes avances solo con el
objetivo de hacer de esta técnica cada vez más eficiente. Se empezó a implementar
en las cerdas debido al cambio que se le hizo al catéter en forma de espiral
permitiendo que al inseminar a la cerda esta no sufra ningún daño en su aparato
reproductor.
Sin embargo la
inseminación artificial en porcinos obtuvo más importancia cuando se pudo
evaluar la calidad del semen extraído del macho reproductor y se pudo mejorar
ésta actividad utilizada cada vez más en las granjas porcinas, desarrollando
nuevos métodos, sistemas de recolección y preparación de las dosis de semen y
mejorando los protocolos de inseminación en condiciones comerciales.
En la actualidad la
inseminación artificial es una técnica que ha intensificado su uso
principalmente en países con alto desarrollo tecnológico (Holanda, Francia,
Alemania, España, Noruega y Finlandia) en los cuales más del 80% de las cerdas
son inseminadas artificialmente, la industria porcina se ha empeñado en los
últimos años en buscar la manera de optimizar la Inseminación Artificial para
hacer un uso más eficiente del semen y de esta manera utilizar machos de alto
valor genético sin estar pendiente de las montas que realiza. (Toalombo. 2007).
La reproducción en
las producciones porcinas es un factor determinante para el éxito productivo de
la granja, ya que de ésta depende gran parte de la rentabilidad de la
producción, la cual, asociada con una alta genética, se va a ver reflejada en
un producto de excelente calidad para el mercado. Por esto, Investigadores a
nivel mundial, han encaminado sus estudios a la búsqueda de aspectos que
indiquen los factores que inciden en la reproducción porcina y con base en
esto, mejorar la práctica de inseminación artificial. (Toalombo. 2007).
Actualmente existen
diferentes opciones disponibles para la aplicación del semen que dependen del
lugar de deposición de la dosis seminal en el tracto genital de la hembra, a
saber: (1) depositar el semen dentro del cérvix, en su parte central y caudal,
conocida como IA cervical, tradicional o convencional; (2) deposición no
quirúrgica del semen en el interior del cuerpo del útero una vez atravesado el
cérvix, conocida como IA post-cervical o trans-cervical; (3) deposición
profunda no quirúrgica del semen al final de un cuerno uterino, conocida como
IA uterina profunda; (4) deposición quirúrgica de los espermatozoides aproximadamente
a 5 cm de la unión utero-tubal. (García, Pallás, Hernández-Gil, Dimitrov).
- LA INSEMINACION ARTIFICIAL
La inseminación
artificial porcina es una aplicación de la biotecnología, que consiste en el
depósito de semen en el tracto genital de la hembra mediante diferentes
instrumentos denominados pipetas o catéteres.
Las técnicas de inseminación
más práctica y en uso a nivel comercial es la técnica convencional y
post-cervical. Para estos métodos existen diferentes modelos de catéteres
disponibles en el mercado, tanto de punta en espiral o de espuma, que, siendo
similares a los tradicionales, sirven de guía para una cánula interior
adicional de unos 73 – 75 cm. Que es la que atraviesa los anillos cervicales y
llega hasta el cuerpo del útero (García, Pallás, Hernández-Gil, Dimitrov).
Una estrategia para
aumentar la tasa de parto y el tamaño de camada de las hembras inseminadas es
estimular el útero y oviductos adicionando oxitocina o alguno de sus análogos,
prostaglandinas, estrógenos al diluyente utilizado durante la preparación de
las dosis o inyectándolas en la propia dosis justo antes de la inseminación de
la hembra.
- SELECCIÓN Y MANEJO DE LOS SEMENTALES
Los machos utilizados
en inseminación artificial se someten previamente a una estricta valoración y
selección genética. Estos machos deben tener un alojamiento conveniente,
recibir una alimentación adecuada y un fuerte control sanitario. Son
rigurosamente examinados en cuanto a aparato locomotor, tamaño testicular,
pruebas de libido, edad, factores medioambientales, posible transmisión de
genes letales o cualquier otra anormalidad.
2.1.RECOLECCIÓN
DEL SEMEN
Constituye la primera
operación a realizar en la técnica de la inseminación artificial. Es necesario
entrenar previamente a los machos reproductores para que se adapten al local,
al método de recogida y a la presencia del operario, con el fin de realizar una
correcta obtención del semen. La estimulación sexual antes de la recogida del
semen incrementa el número de espermatozoides y también el volumen de
eyaculado. Para comenzar a extraer semen en los machos es determinante su edad
y su tamaño testicular. La edad idónea para iniciar a usar a un macho como
donante de semen es de 8 meses.
No realizar la
extracción antes o después de la comida del macho reproductor. En caso de que
se den temperaturas elevadas trabajar con el animal durante las horas más
frescas. (Ediporc. 2009).
Existen dos tipos de extracción. (Ediporc.
2009).
2.1.1. El sistema de parque: Permite al
macho reproductor girar 360 grados, para que pueda explorar y mostrar el
comportamiento típico del cortejo y finalmente montar el potro.
2.1.2. Sistema de pasillo: Se trata de
un sistema que no permite girar al macho reproductor, dejándole como única
opción montar el potro.
Se requiere de un
lugar tranquilo, donde el macho reproductor no se distraiga, se estimula la
libido y adquiere el hábito de saltar rápido y metódicamente sin alterar su
comportamiento sexual.
Para la recolección
del semen se debe tener en cuenta lo siguiente:
1. El operario debe estar atento a la
conducta de cada reproductor conociendo su carácter y efectuando todas las
operaciones con asepsia para evitar las presencia de microorganismos patógenos.
2. El equipo debe estar sanitaria e
higiénicamente preparado para garantizar la calidad del semen. Es necesario el
uso de un potro fijo, o ligeramente móvil donde se acostumbra al reproductor a
eyacular; aunque también puede hacerlo sobre una hembra en celo, éstas deben
tener muy marcado el reflejo de inmovilidad y soportar el peso del semental,
haciendo la recogida al desviar lateralmente el pene. (Grupo Latino Ltda.
2006).
3. MÉTODOS DE RECOLECCIÓN
3.1. Manual: El material
utilizado consta de guantes de látex o vinilo sin polvo que no sean tóxicos
para el esperma (Ediporc. 2009), que no afecte la sensibilidad de la mano y un
termo bien esterilizado, con capacidad para 400 o 500 cm3 y 37 °C de
temperatura a fin de evitar choques térmicos. Mientras el macho reproductor
está eyaculando puede ser recomendable realizar pulsaciones en el pene
(aumentando y disminuyendo la presión ligeramente, con la mano con la que está
sujetando, para estimular dicha eyaculación. (Ediporc. 2009)
3.2. Vagina artificial: El operario
le lleva en su mano derecha y dirige el pene hacia adentro con la mano izquierda.
Al sentir el canal lubricado y los 37 °C de temperatura, el macho reproductor
mueve el pene instantáneamente en forma cilíndrica, se presiona la vagina
mediante una pera de Richardson con lo que se produce la estimulación, el
reproductor erecciona el pene que queda aprisionado iniciando la eyaculación.
(Grupo Latino Ltda. 2006).
Es recomendable usar
un filtro para separar la porción gelatinosa (tapioca) del resto del eyaculado,
ya que favorece la aglutinación de espermatozoides. En ocasiones puede ser
recomendable utilizar una pequeña proporción de diluyente atemperado (50-100
ml, en el vaso o bolsa de recogida), para minimizar el choque térmico que puede
sufrir el esperma y evitar la aparición de aglutinación. (Ediporc. 2009).
4. CARACTERÍSTICAS DEL SEMEN
PORCINO.
La
eyaculación del cerdo se divide en tres fracciones separadas naturalmente:
4.1. Fracción proespermática: La
constituyen secreciones de la próstata, vesículas seminales, es muy
transparente, no contiene espermatozoides y su volumen es de 10 – 15 ml, no se
debe recoger puesto
que su función principal es de limpieza del tracto genitourinario y puede tener
contenido microbiológico. (Grupo Latino Ltda. 2006 y Ediporc.
2009).
4.2. Fracción Espermática: Contiene la
mayor proporción de espermatozoides 80- 90%, su color es blanco lechoso y tiene
una concentración de espermatozoides de
500 000 a 1.000 000 por ml, el volumen oscila entre 3.040 a 90.100 cm3 de
acuerdo a factores como la raza, intervalos de recolecta, factores ambientales,
alimentación y estado sanitario.
4.3. Fracción Posespermática: De
color blanquecino transparente es muy pobre en espermatozoides, menos de 100
000 por ml3, rica en grumos gelatinosos. En la monta natural esta
fracción sirve como taponamiento del útero luego de eyacular el macho
reproductor su fracción espermática.
5. Evaluación del Eyaculado en el
Laboratorio.
Una vez recogido el eyaculado éste debe ser
transportado al laboratorio para su valoración y procesado, en el menor tiempo
posible para evitar cambios en su temperatura y contaminación con el medio
ambiente.
Volumen: Medir el volumen en
centímetros cúbicos o mililitros. Normalmente un macho reproductor eyacula
entre 150 y 250 ml, pero puede variar entre 50 y 500 ml dependiendo de la edad,
raza y tamaño testicular.
Olor: El
semen normal tiene olor proteico neutro. Olores fuertes o específicos indican
que el eyaculado se ensució con orina y secreción prepucial. El olor fétido
indica alteraciones patológicas; el semen con estas características no debe
utilizarse.
Color: El color normal es blanco cremoso. Coloraciones rosadas, amarillas o café, indican presencia de sangre
o alguna sustancia contaminante y el semen debe ser desechado.
Motilidad: Es una medida de la viabilidad del semen. Se realiza
colocando una pequeña gota de semen en un portaobjetos, encima un cubreobjetos;
éstos deben estar a 37ºC. Se observa al microscopio con el objetivo de 10X y se
registra en porcentaje la motilidad observada.
Concentración: Es el número de espermatozoides por unidad
de volumen. Se realiza por diferentes métodos: Cámara de Bürker, cámara de
Neubauer, espermiodensímetro y espectofotómetro. Se realiza para determinar la
concentración, el número de dosis a producir y la cantidad de diluyente
necesario a utilizar. (Mejores Prácticas de producción Porcina. 2006).
Diluyentes: Los diluyentes proveen una fuente adecuada de nutrientes, un ambiente de
protección a los espermatozoides contra la disminución de la temperatura,
electrolitos para mantener una adecuada presión osmótica, antibióticos que
inhiben el crecimiento bacterial. El plasma seminal por sí solo no permite que
haya una conservación duradera del semen. (Grupo Latino Ltda.
2006). Puede ser necesario contar con tres tipo
diferentes de diluyentes:
Diluyente de corta duración, capaz de conservar
el esperma durante 2-3 días, diluyente de media duración, capaz de conservar el
esperma durante 4-5 días y diluyente de larga conservación, capaz de conservar
el esperma durante 7-8 días, para preservar la viabilidad del semen cuando ello
sea necesario durante un periodo más largo.
(Ediporc. 2010).
Envasado: Tras la dilución las dosis podrán repartirse manualmente en frascos, que
posteriormente se cerraran con su capuchón de rosca adaptable a todo tipo de
catéter. Suelen tener una capacidad de 100 ml. (Ediporc.
2010).
Enfriado: La
temperatura del semen debe reducirse de forma gradual una vez que el semen sea
diluido. La reducción de la temperatura se hace en dos o tres horas hasta que
el semen alcance la ideal para su preservación, ésta oscila entre 14 y 17 °C.
Variaciones menores a 14 °C pueden afectar la calidad del semen y superiores a
20 °C no disminuye el metabolismo espermático, ni detienen el crecimiento
bacteriano, disminuyendo la vida útil del semen. Grupo Latino Ltda.
2006)
Almacenamiento: Después del enfriamiento de las dosis protegidas de la luz se deben
conservar en la nevera a 17 – 18 °C.
6. TECNICAS DE INSEMINACION ARTIFICIAL
6.1. INSEMINACION ARTIFICIAL CERVICAL
La técnica de IA
cervical puede realizarse con pipetas o catéteres descartables, tiene por
objetivo depositar el semen dentro del cérvix, en su parte central y caudal. Es
conveniente que la hembra en celo tenga contacto visual con el macho para que
se produzca la cadena de reflejos que acontece en la monta natural.
Los pasos para la
inseminación son: (León. 2006).
·
El primer paso es la identificación de la
hembra.
·
El semen congelado debe calentarse
previamente a la aplicación a una temperatura de 35 °C para lo cual es
necesario disponer de un baño de María o estufa a temperatura, cercano al lugar
de inseminación para evitar pérdidas de calor; en caso contrario se debe
transportar la dosis en termos.
·
Se utiliza una toalla de papel antes de
proceder a la inseminación. Esto ayudará a prevenir adecuadamente la contaminación
del interior del tracto reproductor y una posible infección.
·
Previamente a la aplicación del semen en la
hembra se debe hacer pasar por el catéter una pequeña cantidad de diluyente
puro calentado a 42 °C con el objeto de comprobar la permeabilidad y drenaje
del catéter por si existiera alguna obstrucción, calentar el catéter evitando
que el semen sufra un posible shock térmico.
·
Se debe lubricar el extremo del catéter con
algún lubricante que no sea espermicida para que se deslice suavemente en los
genitales femeninos sin lesionar la mucosa.
·
Introducir cuidadosamente el instrumento por
la vagina hasta el cérvix con un ángulo de 30 – 40 °C.
·
Una rotación en el sentido contrario ala
agujas del reloj la hará penetrar en el cérvix. En ese momento se puede sentir
cierta resistencia al tirar el catéter hacia atrás que nos indica que llegamos
al cuerno utrino.
·
Una vez fijo el catéter, la punta de la
botella se en éste y se introduce la dosis seminal lentamente, debiendo tardar
por los menos de 5 a 10 minutos en ello.
·
Cuidar que no entre aire en el útero.
·
Para retirar el catéter se lo va girando en
sentido horario mientras que se va sacando.
En IA cervical el
número de espermatozoides por dosis inseminante para alcanzar una óptima
fertilidad ha disminuído a 1.5 x 109
espermatozoides en 70 – 100 ml, esto es debido a la mejora de los diluyentes
utilizados. Por cada servicio se utilizan
3.0 x 109 (dos
siembras por cerda). (Lloveras. 2005).
6.2. TÉCNICA DE
INSEMINACIÓN INTRAUTERINA (IA IU)
La inseminación intrauterina se define como la deposición del semen
directamente en el cuerpo del útero. Se distingue dos tipos diferentes de
técnica dependiendo del lugar donde se deposita el semen:
- La Inseminación Artificial Intrauterina Profunda (IA IUP), que deposita el semen en la profundidad de un cuerno uterino.
- La Inseminación Artificial post cervical (IA PC) en la que el semen se deposita en el cuerpo del útero.
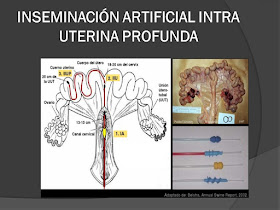
6.2.1. La Inseminación Intrauterina Profunda (IA IUP)
La IA IUP permite depositar los espermatozoides, en la profundidad de un
cuerno uterino de forma rápida y sencilla, aunque el coste del sistema es
elevado, el procedimiento se reserva para dosis seminales criopreservadas o
sexadas. Los estudios llevados a cabo indican que con esta técnica se puede
reducir 20 veces la dosis de inseminación con semen fresco; es decir el número
de espermatozoides/dosis sería 0,15 x 109 y el volumen de la dosis 5
ml sin que la fertilidad a parto y el tamaño de camada se vea afectado, en el
caso de semen congelado el número de espermatozoides a utilizar puede ser
reducida hasta 6 veces. (Vázquez, Roca, Gil, Cuello, Parrilla, Vázquez y Martínez. 2009).
Está técnica Permite que el espermatozoide se
desplace más rápido hasta el sitio de la fertilización y elimina obstáculos en
este recorrido, como las secreciones cervicales; el semen es directamente
depositado en el tercio distal del cuerno uterino, se evitan también las
perdidas por reflujo. (Toalombo. 2007).
Para poder realizar la IA IUP, y depositar los espermatozoides al final
del cuerno uterino se diseñó un catéter de 1.80 metros de longitud, un diámetro
externo de 4mm y un tubo interno de 1.80 mm de diámetro que permite alcanzar el
extremo profundo del cuerno uterino. (Romero. 2012).
El procedimiento de inseminación consiste en hacer pasar este
dispositivo a través de la luz de un catéter de IA tradicional que nos sirve
para fijar el cuello uterino. Una vez situado el catéter de IA tradicional, el
dispositivo de inseminación intrauterina es pasado a través de su luz empujando
suave y a la vez firmemente para superar el canal cervical y progresar hacia el
cuerpo uterino en primer lugar y finalmente alcanzar el cuerno uterino, sin
embargo los espermatozoides son capaces de llegar al oviducto correspondiente
del otro cuerno uterino y fertilizar un alto porcentaje de los ovocitos allí
presentes, siendo necesario un tiempo medio de inseminación de unos 3 a 4
minutos. (Vázquez, Roca, Gil, Cuello, Parrilla, Vázquez y Martínez. 2009).
6.2.2.
La Inseminación Post-cervical (IA PC)
Durante la IA PC el semen se introduce
directamente en el cuerpo del útero utilizando una cánula, más larga (de 74 a
75 cm según el modelo y fabricante). Esta cánula pasa a través de los anillos
del cérvix hasta llegar al cuerpo del útero, y al igual que en la IA IUP es necesario
un catéter de IA tradicional que se utiliza de guía para la introducción de la
cánula. Es muy variable el volumen (de 30 a 80 ml) y la concentración (500,
750, 1000, 1500 x 106 espermios/dosis).
A pesar de que los espermatozoides se
depositan más cerca del útero (20 cm), si se compara con la IA tradicional, las
células espermáticas todavía tienen que recorrer los cuernos uterinos (entre 80
y 130 cm de longitud) hasta llegar al lugar de la fecundación. El número de
espermatozoides disminuye considerablemente durante la fase de transporte hasta
el oviducto. Esto es debido a la adherencia de los espermatozoides al epitelio
uterino.
El volumen de la dosis seminal es
clave en el transporte de los espermatozoides a través del cerviz, cuerpo
uterino y cuernos uterinos para llegar finalmente al oviducto. El cuerpo
uterino proporciona espermatozoides a los dos cuernos uterinos, por lo que
necesita un determinado volumen de semen para garantizar un número mínimo de
espermatozoides que entren en cada cuerno uterino.
La introducción del catéter es un
procedimiento más lento que en la IA tradicional. El catéter post-cervical es
similar al catéter tradicional, pero contiene una sonda en su interior más fina
y larga. El uso de estos catéteres para IA PC, así como la técnica es un poco
diferente a la tradicional, lo que hace necesario e imprescindible la formación
del operario antes de su uso en la explotación. El riesgo de lesiones a nivel
de cuello uterino y el posible daño tisular es alto si el personal no está debidamente
entrenado.
El reflujo de semen en la IA es un
hecho común, que no depende del sitio donde se deposita el semen ni está
relacionado con problemas reproductivos. El reflujo de semen durante o poco
después de la inseminación ha sido considerado por muchos técnicos como un
punto crítico en la técnica de IA. (Romero. 2012).
6.3.
INSEMINACIÓN INTRAUTERINA POR
CIRUGÍA LAPAROSCOPIA.
La cirugía laparoscópica es una técnica para
depositar el semen directamente en el útero o en el oviducto y podría ser realizada
en granjas por personal cualificado. En la cerda, la deposición de los
espermatozoides por laparoscopia se hace en el cuerno uterino, cerca de la
unión utero-tubrica, permitiendo obtener altos porcentajes de fecundación
(92,3%) utilizando únicamente entre 10-20 x 10^6 espermatozoides por cuerno.
Una reducción mayor en el número de espermatozoides, hasta 5 x 10^6, da lugar a
una reducción significativa de las tasas de gestación obtenidas (81,9%).
Para llevar a cabo esta técnica los animales
deben estar anestesiados y colocados en la posición de Trendelemburg en un
ángulo de aproximadamente 20 grados respecto a la horizontal. Una vez
correctamente colocados, procederemos a la realización de una incisión de 1,5
cm cerca del ombligo y tirando de los bordes de la incisión procederemos a la
introducción de un trocar de 12 mm de diámetro (Optiview trocar, Ethicon
Endo-surgery Cincinnati OH, USA) que nos
ayudará a introducir un laparoscopio de 0 dentro de la herida. Una vez que hemos
entrado en la cavidad abdominal, una parte del trocar Optiview es retirado y sustituido por el laparoscopio
de 0. En este momento, la cavidad abdominal es inflada mediante la introducción
de CO2 hasta alcanzar una presión de 12
mmHg y se colocan dos puertos accesorios en el hemi-abdomen derecho en izquierdo, que servirán para la
introducción de unas pinzas Duval de laparoscopia cuya misión será la de manipular los cuernos uterinos y
agarrar el oviducto para poder introducir dentro del mismo la aguja de
inseminación. Tras la introducción del semen en ambos oviductos, los trocares y
puertos son retirados y una mínima sutura será requerida en los puntos de entrada
de los mismos. El tiempo requerido para la realización de esta cirugía de
mínima invasión es de sólo 15 minutos. (Vázquez,
Roca, Gil, Cuello, Parrilla, Vázquez y Martínez. 2009).
7.
VENTAJAS
Y DESVENTAJAS DE LA INSEMINACIÓN ARTIFICIAL.
VENTAJAS. (León. 2006).
·
El uso intensivo de machos reproductores
sobresaliente, sin el peligro de sobre carga sexual.
·
Mejora higiene en la reproducción por
estricto control sanitario de los reproductores destinados a inseminación
artificial, por aislamiento en la granja al no introducir reproductores de
otros establecimientos que podrán ser portadores de enfermedades y por
manipulación del eyaculado y conservación.
·
Utilización de animales que ya no existen o
que no pueden montar en forma natural.
·
Disminución del número de machos con ahorro
de espacios y de costos de mantenimiento.
·
Permite controlar la calidad espermática de
los reproductores.
·
Permite inseminar en poco tiempo, un grupo
numerosas de cerdas, independientemente del lugar donde esté.
·
Producción de lotes más homogéneos con
destino a la planta de beneficio.
·
Ahorro de tiempo y de esfuerzo evitando la
monta natural y el desplazamiento de los reproductores.
·
Se pueden llevar registros de reproducción
más fácilmente, y de esta manera hacer más eficiente el manejo del
establecimiento.
·
Se evita el riesgo de la consanguinidad.
DESVENTAJAS.
·
Cuando la inseminación se realiza de manera
apropiada, sus desventajas son pocas.
·
Exigencia en la formación y mantenimiento de
personal especializado.
·
Utilización de semen de baja calidad
proveniente de animales con características genéticas pobres.
·
Peligros de mala práctica. El momento de
realizar la inseminación no siempre es el óptimo.
·
No realizar una buena aplicación de las dosis
seminales, con fallos en la limpieza de catéteres, una falta de estimulación de
la aplicación (dosis con temperaturas bajas, inseminaciones en poco tiempo).
·
Obtención de pequeño de dosis por eyaculado y
reducido tiempo de conservación del esperma.
CONCLUSIONES
La IA es implementada
en las granjas porcícolas para hacerlas más eficiente y productivas teniendo
menos machos reproductores por hembra y lograr unos menores desgastes en los
machos reproductores. Para implementar éstas prácticas es necesario seleccionar
animales genéticamente eficientes, contar con personal especializado o
entrenado para realizar los
procedimientos teniendo calculado que se deben realizar algunas inversiones
necesarias en equipos de laboratorio.
El manejo del macho
reproductor para la extracción del semen
debe de ser de gran cuidado, ésta etapa es importante en el inicio del proceso
de IA porque de acuerdo a ello puede variar la calidad del material seminal.
Otro aspecto importante es el manejo del semen después de su extracción ya que
puede disminuir o alargar la vida de los espermatozoides por lo cual se tienen normas de inocuidad.
La preparación del
semen para la IA se realiza en el laboratorio en el cual se tiene
estandarizados los procesos de selección, clasificación y almacenamiento
permitiendo tener grandes ventajas respecto al llenado de registros,
manipulación y trasporte al lugar donde se encuentran las hembras para
inseminar.
La inseminación tiene
cuatro técnicas de las cuales solo tres son las más utilizadas ya que la
inseminación artificial quirúrgica necesita de personal idóneo. Las otras
tres técnicas de inseminación como: la
IA cervical o tradicional o convencional, la IA post-cervical o transcervical y
la IA intrauterina, las cuales se diferencian en la posición en donde se aplica
la dosis seminal, en la cantidad de espermatozoides que se necesitan para
garantizar la fertilización en la hembra a inseminar, la IA cervical necesita
aproximadamente 3000 millones de espermatozoides por dosis y las otras dos
aproximadamente la mitad 1500 millones de espermatozoides. Pero otras de sus
diferencias es que la transcervical y la intrauterina profunda necesitan
personal calificado para una óptima inseminación.
La IA requiere que
sus procedimientos se realicen adecuadamente porque se puede afectar el aparato
reproductivo de las hembras o contagiarlo con infecciones, también el
porcentaje de fertilización puede ser
diferente al esperado. Por lo tanto es necesario hacer un buen manejo con estos
métodos que permitan en las granjas porcícolas optimizar recursos humanos,
económicos y tiempo dirigidos a la producción.
BIBLIOGRAFÍA
Especial Genética e
inseminación. Ediporc. 2010. 31:17. [17 de Mayo de 2012] URL:http://www.ediporcguia.com/sites/default/files/revista/GENETICAEINSEMINACION_ediporcguia.pdf
Inseminación
Artificial en Porcinos: “Variación en el tiempo y método de
Ediporc. Especial Inseminación 2009.
Suplemento 127: 32 – 33. [16 de Mayo de 2012] URL: http://www.magapor.com/images/consejoveterinario/iDoc_9.pdf
García Ruvalcaba JA, Pallás Alonso R, Hernández-Gil R, Dimitrov S. Técnica bifásica de IA con plasma seminal
sintético (Predil® MR-A®) como método para facilitar los procedimientos de
inseminación convencional y post-cervical (I). Genética y reproducción. N° 47.
[17 de Mayo de 2012] URL: http://www.anaporc.com/i/pdf65/ACgenetica.pdf
González María, Acosta Sosa Miguel, Williams Sara, Crudeli Gustavo A.
Inseminación Artificial en Porcinos: “Variación en el tiempo y método de
entrenamiento en verracos de diferentes edades en el Noroeste Caqueteño.
Informe Preliminar. 2004. [16 de Mayo
de 2012] URL: http://www.unne.edu.ar/Web/cyt/com2004/4-Veterinaria/V-034.pdf
León Valencia CE. Inseminación
Artificial. 2006.- [19 de Mayo de 2012] URL: http://bibdigital.epn.edu.ec/bitstream/15000/2640/1/CD-0438.pdf
Lloveras
Marcela R. Inseminación artificial en
cerdos. Sección
Mejoramiento Porcino. 2005. [18 de Mayo de 2012] URL:
http://www.gidesporc.com.ar/Fericerdo%202005/FeriLlov.htm
Manual de
Explotación y Reproducción en Porcinos. Grupo Latino Ltda. 2006; 638: 218 –
235.
Mejores
Prácticas de producción Porcina. 2006. Santo Domingo. N° 2; [17 de Mayo de 2012] http://www.gruposuperalba.com/INSITE/fasciculo2.pdf)
Romero Carmen de Alba. La inseminación intrauterina en cerdos: beneficios y
riesgos. 2012;[18 de Mayo de 2012] URL: http://www.minitube.de/US_esl
Toalombo Vargas Paula Alexandra. Evaluación de la inseminación
intrauterina profunda y cervical en cerdas. Tesis de grado. 2007. [17 de Mayo de 2012] URL:
http://dspace.espoch.edu.ec/bitstream/123456789/1750/1/17T0799.pdf
Vázquez
J.M.; Roca J., Gil M. A., Cuello C., Parrilla I., Vázquez J.L. y Martínez E.A. Nuevas perspectivas en la tecnología de
inseminación con número reducido de espermatozoides. (II) Avances en tecnología
porcina. 2009; [20 de mayo 2012] URL:http://www.myvirtualpaper.com/doc/prodive/avances-diciembre-2009/2009121401/14.html#17





















No hay comentarios.:
Publicar un comentario